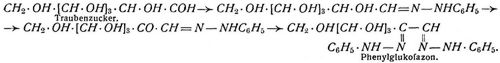- Kohlehydrate
Kohlehydrate. Eine große Gruppe von organischen, aus Kohlenstoff, Wasserstoff und Sauerstoff bestehenden Substanzen, welche miteinander durch enge Beziehungen verknüpft sind und welche von der Natur in gewaltiger Menge im pflanzlichen und tierischen Organismus erzeugt werden, wird seit langem unter dem Namen Kohlehydrate zusammengefaßt, weil sie Wasserstoff und Sauerstoff in dem gleichen Verhältnis 2 : 1 enthalten wie das Wasser, z.B. Traubenzucker C6H12O6 = 6C + 6H2O, Rohrzucker C12H22O11 = 12C + 11H2O.
Die Kohlehydrate lassen sich einteilen in: 1. Einfache Zucker, Monosaccharide oder Hexosen mit der Formel C6H12O6. 2. Zusammengesetzte Zucker: a) Disaccharide oder Hexobiosen und b) Trisaccharide oder Hexotriosen. Sie können aus 2 oder 3 Molekülen Hexose durch Wasseraustritt entstanden gedacht werden und zerfallen durch Wasseraufnahme in 2 oder 3 Moleküle Hexose. 3. Polysaccharide (C6H10O5)x. Sie lassen sich ebenfalls in Hexosen überführen.
[545] Die Aufklärung der Konstitution der Kohlehydrate gehört erst der neueren Zeit an. Durch eine Reihe von hervorragenden Arbeiten, an welchen Kiliani, Scheibler, Tollens, v. Lippmann, Lindner u.a.m., vor allen aber Emil Fischer beteiligt sind, ist die Forschung nicht nur mit einer Fülle von Beobachtungen und einzelnen Tatsachen bereichert, nicht nur zur Erkenntnis der Struktur der in der Natur vorkommenden Kohlehydrate, sondern auch zur Auffindung zahlreicher neuer Zuckerarten geführt worden. Einerseits gelang es, schon bekannte Zucker in andre Vertreter der gleichen Körperklasse umzuwandeln, anderseits führte der synthetische Aufbau zum Erfolg, so daß man heute durch mannigfaltige Abänderung der künstlichen Entstehungsbedingungen eine bedeutend größere Anzahl von Zuckerarten darzustellen vermag, als solche bisher in der Natur aufgefunden worden sind. Die folgende Darstellung beschränkt sich auf die allgemeinen Eigenschaften der einfachen und spaltbaren Zuckerarten, während die Polysaccharide in den Art. Dextrin, Stärkemehl und Cellulose behandelt sind.
I. Die einfachen Zuckerarten oder Monosaccharide.
Vorkommen und Bildungsweise. Die Monosaccharide kommen zum Teil fertig gebildet in der Natur vor, wie Trauben- und Fruchtzucker. Sie entstehen aus komplizierteren natürlichen Kohlehydraten, wie Rohrzucker, Gummi, Stärke, Cellulose, ebenso aus den Glykosiden (s.d.), durch hydrolytische Spaltung. Ueber künstliche Synthesen s. [2].
Konstitution. Alle Zuckerarten besitzen eine normale offene Kohlenstoffkette und sind gesättigte Verbindungen. Ein Sauerstoffatom enthalten sie in Form einer CO-Gruppe; sie sind also Aldehyde oder Ketone. Die übrigen Sauerstoffatome sind in Form von alkoholischen OH-Gruppen vorhanden. Damit sind die Monosaccharide als Aldehydalkohole oder Ketonalkohole charakterisiert und werden, je nachdem sie eine Aldehyd- oder Ketongruppe enthalten, als Aldosen oder Ketosen bezeichnet. Man hat nun alle nur Alkoholgruppen und eine Aldehyd- resp. Ketongruppen enthaltenden Kohlenstoffverbindungen mit offener Kette als Zucker bezeichnet und unterscheidet nach der Anzahl der Kohlenstoffatome Biosen, Triosen, Tetrosen, Pentosen u.s.w.
Eigenschaften und Verhalten. Die Monosaccharide sind farblose, süß schmeckende Körper, welche sich leicht in Wasser, schwer in Alkohol, nicht in Aether lösen, in reinem Zustand gut kristallisieren, in unreinem Zustand dagegen meist sirupförmig bleiben und beim Erhitzen sich unter Bräunung, schließlich unter Verkohlung zersetzen. Alle Zuckerarten existieren in zwei optisch aktiven und der racemischen inaktiven Modifikation, da sie stets eine größere Zahl von asymmetrischen Kohlenstoffatomen enthalten. Das Drehungsvermögen ist daher eine der wichtigsten physikalischen Konstanten dieser Körper, welche auch zur Bestimmung des Prozentgehaltes von Zuckerlösungen benutzt werden kann. Ueber die Ausführung s. [3] und Zucker. Frisch bereitete Zuckerlösungen zeigen häufig andre Werte für die Drehung als solche, welche längere Zeit gestanden haben oder aufgekocht, bezw. mit sehr kleinen Mengen Ammoniak versetzt worden sind. Diese Erscheinung wird, wenn die Drehung allmählich heruntergeht und der schließlich beobachtete konstante Winkel kleiner ist als der zuerst beobachtete, als Birotation oder Mehrdrehung und im umgekehrten Fall als Halbrotation oder Wenigerdrehung bezeichnet. Die Ursache derselben ist noch nicht aufgeklärt. Mit Basen, wie Strontian und besonders Kalk, bilden die Zuckerarten lose, alkoholatartige Verbindungen, welche durch Kohlensäure zersetzt werden und sich an der Luft durch Oxydation bräunen. Alkalien wirken unter Bräunung und Milchsäurebildung zersetzend auf die Zucker ein. – Durch Kochen mit Essigsäureanhydrid entstehen Acetylderivate. Die besprochenen Reaktionen beruhen auf der Gegenwart der Hydroxylgruppen; das Vorhandensein einer Aldehyd- bezw. Ketongruppe geht aus folgenden Reaktionen hervor. Die Monosaccharide sind leicht oxydierbar und reduzieren daher ammoniakalische Silberlösung sowie beim Erwärmen Fehlingsche Lösung (s.d.); auch dies Verhalten läßt sich zur quantitativen Bestimmung von Zuckerlösungen benutzen [4]. Durch Natriumamalgam werden die Monosaccharide zu den entsprechenden Alkoholen reduziert, mit Hydroxylamin liefern sie Oxime. Diese lassen sich für den Abbau der Aldosen verwerten. Mit Phenylhydrazin entstehen zunächst unter Austritt eines Moleküls Wasser Hydrazone von der Zusammensetzung z.B. C2H12C5 = N – NH · C6H5. Auf diese wirkt ein weiteres Molekül Phenylhydrazin oxydierend ein, indem es 2 Atome Wasserstoff herausnimmt und dadurch in Ammoniak und Anilin gespalten wird. Das oxydierte Zuckerhydrazon seinerseits vermag nun mit einem weiteren Molekül Phenylhydrazin unter abermaliger Wasserabspaltung zusammenzutreten zu einem sogenannten Osazon, dessen Entstehung durch folgende Formeln veranschaulicht wird:
Diese Osazone nun – gelbgefärbte, kristallisierende, in Wasser völlig unlösliche Verbindungen – scheiden sich auch aus sehr verdünnten Zuckerlösungen aus. Das Phenylhydrazin ist daher in der Zuckergruppe zu einem ungemein wichtigen Reagens geworden, nicht nur, weil es häufig das einzige Mittel ist, einen Zucker aus seiner Lösung abzuscheiden und ihn zu charakterisieren, sondern auch, weil man die Osazone wieder in Zuckerarten zurückverwandeln kann. Dies gelingt durch Reduktion mit Zinkstaub und Essigsäure und Behandlung der entstandenen Osamine mit salpetriger Säure oder durch Kochen der Osazone mit Salzsäure und darauffolgende Reduktion der gebildeten Osone mit Zinkstaub und Essigsäure. Die Monosaccharide addieren Blausäure unter Bildung von Cyanhydrinen, welche durch Verseifung in Säuren, z.B.
übergehen. Diese Säuren werden durch Natriumamalgam zu Aldehyden reduziert, welche [546] homologe synthetische Zuckerarten sind. Auf diese Weise sind die Heptosen, Oktosen, Nonosen künstlich dargestellt worden. Auch die gelinde Oxydation der Aldosen ist für die künstliche Gewinnung von Zuckerarten von Bedeutung geworden. Näheres darüber s. unter [1]. Die meisten Monosaccharide werden durch Hefe zu Alkohol und Kohlensäure vergoren; durch Spaltpilze erleiden sie die Milchsäure-, Buttersäure- und schließlich die schleimige Gärung (s.d.).
A. Triosen und Tetrosen. Glyzerose C3H6O3 und Erythrose C4H8O4 sind künstlich erhalten und durch ihre Osazone charakterisiert worden.
B. Pentosen C5H10O5. Die Pentosen sind bisher in der Natur nicht als solche aufgefunden worden, sondern entstehen durch hydrolytische Spaltung besonders von Gummiarten. Bei der Destillation mit Mineralsäuren liefern sie Furfurol. Mit Hilfe dieser Reaktion und der quantitativen Bestimmung des Furfurols läßt sich annäherungsweise der Gehalt verschiedener Rohprodukte an pentosebildenden Stoffen (Pentosanen) berechnen. Auf diese Weise kann man Pentosane in der Kleie, in Biertreber, Heu, Stroh, Holz u.s.w. nachweisen, und hieraus ergibt Pich, daß die Pentosen namentlich zum Aufbau des pflanzlichen Zellstoffs dienen. Die bis jetzt bekannten Pentosen sind Aldosen. – Arabinose, gewöhnliche Arabinose oder Pektinzucker, entsteht durch Kochen von arabischem Gummi mit verdünnter Schwefelsäure, ist stark rechtsdrehend und kristallisiert in Prismen, welche bei etwa 160° schmelzen und süß schmecken. Die linksdrehende Arabinose ist durch Abbau des Traubenzuckers und die inaktive Modifikation durch Vermischen der beiden vorigen künstlich erhalten worden. – Xylose (Holzzucker), stereoisomer mit Arabinose, wird aus Holzgummi erhalten, kristallisiert in Prismen, welche bei 140–160° schmelzen und schwach rechtsdrehend sind. – Rhamnose C6H12O5 ist eine Methylpentose CH3 ·[CH · OH]4 · CHO, welche aus verschiedenen Glykosiden, namentlich aus dem in den Gelbbeeren enthaltenen Xanthorhamnin durch Kochen mit verdünnter Schwefelsäure gewonnen wird. Sie kristallisiert mit 1 Molekül Wasser in glänzenden Kristallen, welche sehr süß schmecken, in wässeriger Lösung rechts und in alkoholischer Lösung links drehen. Wasserfrei schmilzt die Rhamnose bei 93°. Außer diesen Pentosen ist noch die Ribose künstlich und die Fukose aus Seetang durch Hydrolyse dargestellt worden.
C. Hexosen oder Glykosen C6H12O6. Zu den Hexosen gehören die am längsten bekannten Zuckerarten, wie Traubenzucker, Fruchtzucker, Galaktose, welche demgemäß am besten erforscht sind und früher als die einfachsten Zuckerarten betrachtet wurden, eine Auffassung, welche durch die Erkenntnis der Arabinose als einer Pentose hinfällig ist. Die meisten Hexosen vergären direkt; durch Kochen mit verdünnten Säuren liefern sie Lävulinsäure. Ueber die räumliche Konfiguration der stereoisomeren Hexosen sowie über die Bedeutung der Zeichen d und l bei diesen s. [5].
1. Aldosen: Traubenzucker (Dextrose), systematisch als d-Glykose bezeichnet, kommt in den meisten fußen Früchten neben Fruchtzucker, aber auch in Wurzeln, Samen, Blüten vor. Bekannt ist ferner das Auftreten von Traubenzucker im Harn bei Diabetes. Er entsteht durch Hydrolyse vieler Glykoside und Polysaccharide. Die d-Glykose kristallisiert aus Methylalkohol wasserfrei in seinen Nadeln oder harten Krusten vom Schmelzpunkt 146°, aus wässeriger Lösung mit 1 Molekül Kristallwasser in Täfelchen. Dextrose schmeckt weniger süß als Rohrzucker, ist in Wasser sehr leicht, in Alkohol kaum, in Methylalkohol ziemlich löslich, ist rechtsdrehend und zeigt Mehrdrehung. Der Traubenzucker ist ein Aldehydalkohol, liefert bei der Reduktion den sechswertigen Alkohol Sorbit und vergärt direkt. Die frühere Darstellung der Dextrose aus Trauben wird nicht mehr technisch ausgeführt, sondern man verwendet als Ausgangsmaterial die Stärke. Die Stärke wird durch Kochen mit verdünnter Schwefelsäure (11/2%) in Dextrose verwandelt. Die Säure wird mit Kalk neutralisiert, die Lösung vom ausgeschiedenen Gips abgezogen und im Vakuum so weit eingedampft, daß sie beim Abkühlen erstarrt. Je nach Herkunft der Stärke wird der Traubenzucker im Handel entweder als Stärkezucker oder als Kartoffelzucker bezeichnet. Ueber die Herstellung von Stärkezucker aus Mais, wie sie in Amerika üblich ist, s. [6]. Der Traubenzucker aus Stärke findet als Ersatzmittel des Zuckers der Trauben Anwendung zum Versüßen von Wein, in der Zuckerbäckerei und Bonbonsfabrikation, dann bei der Bereitung von Marmeladen und Senf und in Tabakfabriken, und schließlich zur Darstellung der Zuckercouleur, welche wie das Karamel zum Färben von Likören dient. Die Zuckercouleur aus Stärkezucker wird durch Erhitzen der Substanz in Kesseln bis zur Bildung einer dunkelbraunen Schmelze dargestellt, welche dann in Wasser zu einer dickflüssigen, dunkeln Flüssigkeit gelöst wird. – Die linksdrehende Modifikation des Traubenzuckers, die l-Glykose, ist künstlich aus l-Arabinose und die i-Glykose durch Vermischen der beiden optischen Antipoden erhalten worden. – d-Mannose, gleichfalls eine Aldose, stereoisomer mit Dextrose, entsteht neben Fruchtzucker durch vorsichtige Oxydation des Mannits (s.d.), ferner durch Kochen von Reservecellulose der Samen mit verdünnter Schwefelsäure. Ein billiges Ausgangsmaterial für die Darstellung der Mannose sind die Abfallspäne bei der Fabrikation von Knöpfen aus Steinnüssen. Leicht zerreibliche und zerfließliche Masse, in Wasser sehr leicht löslich, dreht schwächer rechts wie Dextrose, und liefert bei der Reduktion mit Natriumamalgam den gleichen Mannit zurück, aus welchem sie entsteht. Auch die linksdrehende und die inaktive Mannose sind bekannt. – d-Galaktose entsteht neben Traubenzucker durch Hydrolyse von Milchzucker. Feine Nadeln, Schmelzpunkt 143°; rechtsdrehend, liefert bei der Reduktion Dulcit (s.d.). Die inaktive Modifikation ist durch eine Reihe von Umwandlungen aus der d-Modifikation erhalten worden. Bei der Gärung der i-Galaktose wird d-Galaktose aufgezehrt und es bleibt l-Galaktose übrig, welche der d-Modifikation sehr ähnlich ist. An künstlich dargestellten Aldosen der Hexofenreihe sind noch anzuführen die drei Modifikationen, die Gulose, die Talofe und die Rhamnohexose.
2. Ketosen: Fruchtzucker (Lävulose), systematisch d-Fruktose, die Zuckerart, welche den Traubenzucker in den fußen Früchten begleitet. Ein Gemisch gleicher Teile von[547] Trauben- und Fruchtzucker ist der sogenannte Invertzucker (s.d.), welcher durch Hydrolyse des Rohrzuckers entsteht. Ein natürlich vorkommender Invertzucker ist der Honig. Fruchtzucker entsteht auch, wie erwähnt, bei der vorsichtigen Oxydation von Mannit neben Mannose und ferner aus dem Osazon des Traubenzuckers. Man hat also in dieser Reaktion einen Weg, um Traubenzucker in Fruchtzucker umzuwandeln. Der Fruchtzucker kristallisiert schwierig, aus Alkohol in harten, wasserfreien, rhombischen Kristallen vom Schmelzpunkt 95°; er dreht stärker nach links als Traubenzucker nach rechts; daher ist Invertzucker schwach linksdrehend. Er vergärt leicht und vollständig mit Hefe, durch Reduktion mit Natriumamalgam liefert er Mannit und Sorbit nebeneinander. Da der Fruchtzucker aus dem Invertzucker nur schlecht zu isolieren ist, so stellt man ihn durch Hydrolyse eines Kohlehydrats dar, welches hierbei nur in Fruchtzucker zerfällt. Das ist das Inulin (C6H10O5)x + H2O, welches in den Kompositen vorkommt und in diesen Pflanzen die Rolle eines Reservestoffes spielt. Durch Erwärmen von Inulin mit schwach angesäuertem Wasser kann man leicht reinen Fruchtzucker gewinnen. – Die inaktive Modifikation des Fruchtzuckers (i-Fruktose) ist darum höchst bemerkenswert, weil sie diejenige Zuckerart ist, welche zuerst in einheitlichem Zustand aus einem Gemisch von synthetisch dargestellten Kohlehydraten abgeschieden worden ist. Solche synthetische Gemische sind von Butlerow und von Löw durch Einwirkung von Kalkwasser auf Formaldehyd – Methylenitan und Formose – und von Fischer und Tafel durch Einwirkung von Barytwasser auf Akroleinbromid (s. Akrolein), oder auf rohen Glyzerinaldehyd oder Glyzerose erhalten worden. Aus diesen Gemischen lassen sich die künstlichen Zuckerarten durch ihre Osazone abscheiden; man erhält ein Gemenge von Osazonen, aus welchen sich dasjenige der i-Fruktose isolieren läßt. Die aus dem Osazon auf den oben angedeuteten Wegen erhaltene Zuckerart zeigt alle Reaktionen des natürlichen Fruchtzuckers, abgesehen davon, daß sie optisch inaktiv ist. Durch Reduktion liefert sie inaktiven Mannit. Da die inaktive Fruktose zuerst aus dem Akrolein erhalten worden ist, so hat sie Fischer auch als Akrose und zwar zur Unterscheidung von isomeren, gleichzeitig gebildeten Verbindungen als α-Akrose und den inaktiven Mannit als α-Akrit bezeichnet. Die inaktive Fruktose vergärt mit Hefe, indem der natürliche Fruchtzucker aufgezehrt wird und l-Fruktose, also die rechtsdrehende Modifikation des Fruchtzuckers, übrigbleibt. Näheres s. unter [7]. – Eine fernere Ketose ist die Sorbinose, welche aus dem Saft der Vogelbeeren isoliert werden kann, farblose, rhombische Kristalle bildet und linksdrehend ist. Sie ist wahrscheinlich mit Fruchtzucker stereoisomer.
D. Heptosen, Oktosen, Nonosen. Monosaccharide mit mehr als sechs Sauerstoffatomen sind, wie erwähnt, bisher in der Natur nicht aufgefunden worden. Die hierher gehörigen Zuckerarten sind daher alle künstlich dargestellt worden, und zwar, von den Hexosen ausgehend, vermittelst Anlagerung von Blausäure und Reduktion der Säuren, welche durch Verseifung der entstandenen Cyanhydrine erhalten werden. Von den bisher gewonnenen Zuckerarten seien angeführt: d-Mannoheptose C7H14O7, d-Mannooktose C8H16C8, d-Mannononose C9H18O9, und die entsprechenden α- und β-Glykoheptose, Glykooktose, Glykononose.
II. Zusammengesetzte Zuckerarten.
Die zu dieser Gruppe gehörigen Zuckerarten kommen fertig gebildet in der Natur vor, wie Rohrzucker, Milchzucker, Raffinose u.s.w. Sie entstehen ferner aus komplizierteren Kohlehydraten durch partielle hydrolytische Spaltung, so Maltose aus Stärke. Gleich den Glykosen farblose, neutrale Verbindungen kristallisieren sie leichter und sind beständiger als jene, besitzen aber ähnliche Löslichkeitsverhältnisse und sind optisch aktiv. Sie leiten sich sämtlich von den Hexosen durch Verlust von Wasser ab und enthalten daher Multipla von sechs Kohlenstoffatomen; die Disaccharide besitzen dementsprechend die Zusammensetzung C12H22O11 = 2C6H12O6 – H2O – Hexobiosen –, die Trisaccharide die Formel C18H32O16 = 3C6H12O6 – 2H2O – Hexotriosen. Allgemein zerfallen sie bei der Einwirkung von verdünnten Säuren in der Wärme oder von Fermenten, also bei der hydrolytischen Spaltung, in Monosaccharide. Zuweilen tritt als Spaltungsprodukt nur eine Hexose auf, wie z.B. Traubenzucker aus Maltose; gewöhnlich aber entstehen mehrere isomere Hexosen nebeneinander, so Trauben- und Fruchtzucker aus Rohrzucker, Galaktose, Trauben- und Fruchtzucker aus Raffinose. Diese Spaltung ist nichts andres als eine Zufuhr von Walter, und aus dem Umstande, daß sie äußerst leicht eintritt, kann gefolgert werden, daß bei dieser Wasserzufuhr nicht Kohlenstoffatome voneinander getrennt werden, sondern daß in den Di- und Trisacchariden nur Sauerstoffatome die Bindung zwischen den einzelnen Hexosemolekülen vermittelst.
A. Disaccharide oder Hexobiosen C12H22O11. Rohrzucker, im Pflanzenreich sehr verbreitet. Er findet sich oft neben den Hexosen in manchen Früchten, so in den Ananas und in den Erdbeeren, besonders aber in den Wurzeln der Zuckerrübe (bis etwa 16%) und in den Stengeln der Zuckerhirse und des Zuckerrohrs, aus welchem er technisch gewonnen wird. Der Rohrzucker bildet große, klare, monokline Kristalle, ist in Wasser sehr leicht, in Alkohol schwer löslich und stark rechtsdrehend. Er schmilzt bei 160° und erstarrt zu dem amorphen Gerstenzucker (s.d. und Kandiszucker), höher erhitzt, bräunt er sich zunächst unter Bildung von Karamel und zersetzt sich schließlich unter Abscheidung einer porösen Kohle und Entwicklung von Gasen und Dämpfen. Er reduziert nicht Fehlingsche Lösung, ist nicht gärfähig und reagiert nicht mit Phenylhydrazin. Durch Hydrolyse – entweder durch Kochen mit verdünnter Säure oder durch das in der Hefe enthaltene Ferment Invertin – liefert er ein Gemenge von Trauben und Fruchtzucker (Invertzucker), welches nun Fehlingsche Lösung reduziert und mit Hefe vergärt. Mit Kalk und Strontian liefert der Rohrzucker Saccharate, so Monocalcium-, Dicalcium- und Tricalciumsaccharat C12H22O11, CaO + H2O, C12H22O11 2CaO, C12H22O11, 3CaO + 3H2O, welche als Niederschläge erhalten werden, wenn man die entsprechenden Mengen Kalk in einer Zuckerlösung auflöst und mit Alkohol fällt oder aufkocht. Sie finden bekanntlich bei der technischen [548] Gewinnung des Zuckers zur Reinigung desselben Anwendung. – Ueber die Fabrikation des Rohrzuckers s. Zucker.
Milchzucker (Laktose, Laktobiose) findet sich in der Milch der Säugetiere (3–6%) und wird aus den »Molken« – der Flüssigkeit, welche nach Abscheidung des Kaseins und des Fetts aus der Milch zurückbleibt – durch Abdampfen und Umkristallisieren gewonnen. Er kristallisiert mit 1 H2O in harten rhombischen Prismen, schmeckt wenig süß, ist in Wasser weniger löslich wie Rohrzucker, ist stark rechtsdrehend und zeigt starke Mehrdrehung. Er wird bei 130° wasserfrei, färbt sich bei höherer Temperatur und schmilzt unter Zersetzung bei etwa 200°. Durch Hydrolyse zerfällt er in d-Galaktose und in d-Glykose, reduziert Fehlingsche Lösung, reagiert mit Phenylhydrazin, ist aber nicht direkt gärfähig, – Maltose entsteht aus Stärke durch Einwirkung der Diastase (s.d.). Sie bildet seine weiße Nadeln, welche mit 1 Molekül H2O kristallisieren und bei 100° wasserfrei werden; leicht löslich in Wasser, stark rechtsdrehend, zeigt Wenigerdrehung, reduziert Fehlingsche Lösung, liefert bei der Hydrolyse lediglich Traubenzucker, reagiert mit Phenylhydrazin und vergärt mit riefe leicht und vollständig. Jedoch geht der Vergärung eine Inversion in Traubenzucker voraus. Die Maltose ist von besonderer Bedeutung für die Gärungsgewerbe und ist die Zuckerart, welche in den Kartoffel- und Getreidebranntweinmaischen enthalten ist. Nach Soxhlet werden zur Darstellung reiner Maltose 2 kg Kartoffelstärke mit 9 l Wasser im Wasserbade verkleinert, zu dem 60–65° warmen Kleister ein bei 40° bereiteter Aufguß von 120–140 g lufttrockenem Malz hinzugefügt, 1 Stunde auf der angegebenen Temperatur erhalten, schließlich zum Kochen erhitzt, heiß filtriert und in flachen Schalen bis zur Sirupkonsistenz eingedampft. Der Sirup wird mehreremal mit 90 prozentigem Alkohol ausgekocht und davon eine kleine Menge durch Ausziehen mit absolutem Alkohol und Kristallisieren in dünner Schicht zur Kristallisation gebracht. Diese Kristalle dienen zum Impfen. Die mit 90prozentigem Alkohol erhaltenen Auszüge werden, nachdem der größte Teil des Alkohols abdestilliert ist, zum dicken Sirup abgedampft und mit geringen Mengen der bereits erhaltenen Kristalle versetzt »geimpft«. Nach 3–5 Tagen erstarren dann die Sirupe zu braunen Kristallmassen, welche zur Entfernung des anhängenden braunen Sirups mit Methylalkohol gewaschen werden. Schließlich kristallisiert man aus Wasser um.
Isomaltose entsteht synthetisch aus Traubenzucker durch Einwirkung von rauchender Salzsäure bei 10–15° und ist somit im technischen Stärkezucker enthalten. Sie entsteht ferner als Zwischenprodukt bei der Einwirkung von Diastase auf Stärke und wird durch Diastase vollständig in Maltose übergeführt. Da sie sehr langsam vergärt, so ist sie auch nach der Gärung noch im Bier enthalten und ist anscheinend von großer Bedeutung für die Eigenschaften der verschiedenen Biere. Die Isomaltose schmeckt sehr süß und beginnt schon bei 65° in gelbbraune, noch süß schmeckende Röstprodukte überzugehen, welche zum Teil das »Röstaroma des Darrmalzes« bedingen. Bei höherer Temperatur entstehen dunkelbraune, bitterschmeckende Zersetzungsprodukte. Ihr Drehungsvermögen ist fast gleich dem der Maltose.
Außer den genannten sind noch folgende Disaccharide bekannt: Trehalose aus frischen Pilzen, nicht gärungsfähig, rechtsdrehend, liefert bei der Hydrolyse Traubenzucker; Melebiose entsteht durch partielle Hydrolyse neben Fruchtzucker aus Raffinose; stark rechtsdrehend; Turanose wird durch partielle Hydrolyse der Melezitose erhalten, schmilzt bei 65–70° und ist rechtsdrehend.
B. Trisaccharide oder Hexotriosen C18H32O16. Raffinose oder Meletriose C18H32O16 + 5H2O findet sich in den Rüben in geringer Menge und häuft sich in der Melasse an; sie ist ferner aus Baumwollsamen, aus der Eucalyptusmanna und aus Gerste gewonnen worden. Die Raffinose kristallisiert mit 5H2O in seinen Nadeln oder Prismen, löst sich leicht in Wasser und Methylalkohol, dagegen nicht in Aethylalkohol und ist stark rechtsdrehend. Da sie bedeutend stärker als Rohrzucker dreht, so kann raffinosehaltiger Rübenzucker eine Drehung zeigen, welche bei der quantitativen Umrechnung auf den Zuckergehalt der Lösung eine Zahl über 100% ergibt. Ein solcher Zucker wird technisch als »Pluszucker« bezeichnet. Raffinose reduziert Fehlingsche Lösung nicht. Sie wird von untergärigen Hefen vollständig vergoren; obergärige Hefen zerlegen sie in Fruktose und Melebiose, von denen nur die erstere vergoren wird. Darauf beruht eine Anwendung zum Nachweis untergäriger Bierhefe in der meist obergärige Arten enthaltenden Preßhefe. Bei der Hydrolyse zerfällt sie zunächst in Fruchtzucker und Melebiose und diese dann in Traubenzucker und Galaktose. – Melezitose, eine in mehreren Mannasorten aufgefundene Hexotriose, kristallisiert mit 2H2O in rhombischen Prismen und wird durch Hydrolyse zunächst in Dextrose und Turanose, schließlich vollständig in Dextrose gespalten. – An Zuckerarten von noch höherem Molekulargewicht kennt man die Gentianose, die Stachyose und das Laktosin.
Literatur: [1] Ladenburgs Handwörterbuch der Chemie, Breslau 1888, Artikel Kohlehydrate von B. Tollens, Bd. 6, S. 1–198; Tollens, Kurzes Handbuch der Kohlehydrate, Breslau 1888; Beilstein, Handbuch der organ. Chemie, 3. Aufl., Hamburg und Leipzig 1893, Bd. 1, S. 1034–1110; Meyer und Jacobson, Lehrbuch der organ. Chemie, Leipzig 1893, Bd. 1, S. 876–945. – [2] Fischer, E., Vortrag über »Synthesen in der Zuckergruppe«, Berichte der Deutschen chemischen Gesellschaft, Bd. 23, S. 2114, und Bd. 27, S. 3189. – [3] Wiedemann-Ebert, Physikalisches Practicum, Braunschweig 1890, S. 329; Landolt, Das optische Drehungsvermögen organischer Substanzen, Braunschweig 1879. – [4] Tollens, Handbuch der Kohlehydrate, Breslau 1888, S. 70; Fresenius, Anleitung zur quant. ehem. Analyse, Braunschweig 1877–1887, Bd. 2, S. 586. – [5] Meyer und Jacobson, Lehrbuch der organ. Chemie, Leipzig 1893, S. 609 und 896. – [6] Fischer, Ferd., Handbuch der ehem. Technologie, Leipzig 1893, S. 849. – [7] Meyer und Jacobson, Lehrbuch der organ. Chemie, Leipzig 1891, S. 903 ff.
H. Herzfeld.
http://www.zeno.org/Lueger-1904.